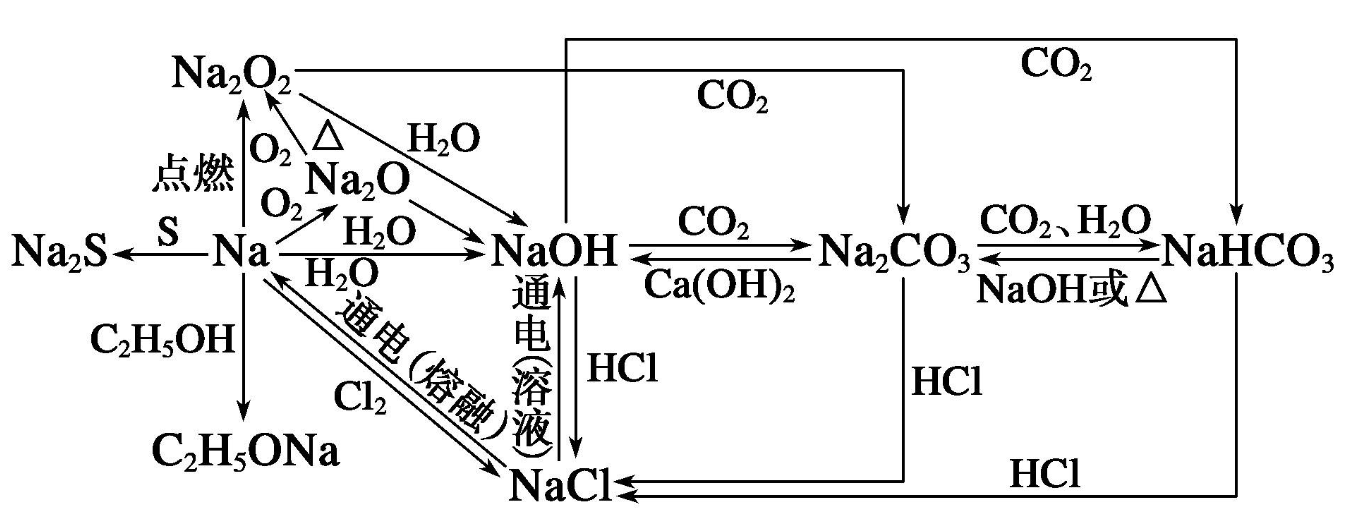
氢气和氮气反应的化学方程式
的有关信息介绍如下: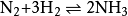 (该反应为可逆反应,等号上反应条件为:“高温高压”,下为:“催化剂”)
(该反应为可逆反应,等号上反应条件为:“高温高压”,下为:“催化剂”)
在无催化剂时,氨的合成反应的活化能很高,大约335kJ/mol。加入铁催化剂后,反应以生成氮化物和氮氢化物两个阶段进行。第一阶段的反应活化能为126kJ/mol~167kJ/mol,第二阶段的反应活化能为13kJ/mol。
德国化学家哈伯(F.Haber,1868-1934)从1902年开始研究由氮气和氢气直接合成氨。于1908年申请专利,即“循环法”,在此基础上,他继续研究,于1909年改进了合成,氨的含量达到6上。
这个方法是工业普遍采用的直接合成法。反应过程中为解决氢气和氮气合成转化率低的问题,将氨产品从合成反应后的气体中分离出来,未反应气和新鲜氢氮气混合重新参与合成反应。
氢气与氨气反应意义:
氨是重要的无机化工产品之一,在国民经济中占有重要地位,其中约有80%氨用来生产化学肥料,20%为其它化工产品的原料。氨主要用于制造氮肥和复合肥料,例如尿素、硝酸铵、磷酸铵、氯化铵以及各种含氮复合肥,都是以氨为原料的。氨作为工业原料和氨化饲料,用量约占世界产量的1/2。
硝酸、各种含氮的无机盐及有机中间体、磺胺药、聚氨酯、聚酰胺纤维和丁腈橡胶等都需直接以氨为原料。
液氨常用作制冷剂,贮运商品氨中有一部分是以液态由制造厂运往外地。
此外,为保证制造厂内合成氨和氨加工车间之间的供需平衡,防止因短期事故而停产,需设置液氨库。液氨库根据容量大小不同,有不冷冻、半冷冻和全冷冻三种类型。液氨的运输方式有海运、驳船运、管道运、槽车运、卡车运。
参考资料:百度百科-合成氨